L'ibridazione come strumento di gestione della conservazione
Traduzione a cura di Angelo Petretta
Segnalazione a cura di Alessandro Sciarrillo
Articolo originale:
Hybridization as a conservation management tool
Wing Yan Chan, Ary A. Hoffmann, Madeleine J. H. van Oppen
https://doi.org/10.1111/conl.12652
Riassunto
La recente vasta perdita di biodiversità solleva la questione del se gli organismi riusciranno ad adattarsi in tempo per sopravvivere all’attuale era di rapidi cambiamenti ambientali e se le pratiche e le politiche di conservazione odierne sono appropriate. Nell’articolo verranno esaminati i vantaggi e i rischi dell’ibridazione (o ibridizzazione) inter e intraspecifica come strumento di gestione della conservazione volti ad incrementare le potenzialità adattive e di sopravvivenza, con particolare riferimento alle barriere coralline. La conclusione è che l’ibridazione è sottoutilizzata e che molti dei rischi considerati sono probabilmente sopravvalutati; le poche applicazioni dell’ibridazione nella conservazione, ad oggi, hanno già mostrato esiti positivi. Le percezioni del potenziale rischio cambiano in modo significativo quando l’obiettivo della conservazione è quello di preservare il potenziale adattivo di una specie/popolazione, invece di preservare la specie nel suo status originario.
Inoltre, suggeriamo che lo status giuridico incerto degli ibridi come entità di protezione può essere costoso per la società e gli ecosistemi; una revisione legislativa del concetto di ibrido e della ibridazione è già in ritardo.
Verrà pertanto presentato un “albero decisionale” per aiutare a valutare quando e dove l’ibridazione può essere uno strumento di conservazione adatto e se l’ibridazione inter- o intraspecifica è l’opzione da preferire.
1.Evitare l'estinzione attraverso l'adattamento genetico
L’adattamento genetico è uno dei modi con cui una popolazione o le specie possono evitare l’estinzione causata da rapidi cambiamenti ambientali (Hamilton & Miller 2016; Hoffmann et al., 2015; Hoffmann & Sgrò 2011). Se una specie si adatterà nel tempo per sfuggire all’estinzione dipende da fattori come il tasso di cambiamento ambientale, la quantità di variazione genetica adattiva presente e il tempo di generazione (Hamilton, Royauté, Wright, Hodgskiss, & Ledig, 2017; Hoffman et al., 2015; Hoffmann& Sgrò 2011).
A livello globale, la temperatura è aumentata e continua ad aumentare a un ritmo mai sperimentato prima dalla vita sulla Terra da almeno 50 (se non centinaia di) milioni di anni (Gaffney & Steffen, 2017; Hönisch et al., 2012). Sebbene l’Accordo di Parigi del 2015 ha fissato l’obiettivo di limitare il riscaldamento a meno di 1,5◦C rispetto alle temperature preindustriali entro il 2100, questo obiettivo è probabilmente irraggiungibile in base alle previsioni attuali per cui le temperature globali dovrebbero aumentare di 2–4,9◦C (Raftery, Zimmer, Frierson, Startz e Liu, 2017).
Gli impatti negativi del riscaldamento sono evidenti da molti esempi negli ambienti marini e terrestri (Chefaoui, Duarte, & Serrao, 2018; Hughes et al., 2018; Klein, Cahanovic, Sprintsin, Herr e Schiller, 2019; Pecl et al., 2017), e forse tra gli ecosistemi maggiormente colpiti ci sono le barriere coralline.
Glossario

Negli ultimi 30 anni, la metà dei coralli del mondo è andata perduta (The Ocean Agency 2018) a causa di stress antropici, compreso il riscaldamento degli oceani. Un certo livello di rapido adattamento e/o acclimatazione è possibile, come dimostrato da un numero di casi di maggiore tolleranza allo sbiancamento nei coralli a seguito di eventi di sbiancamento di massa (Berkelmans, 2009; Guest et al., 2012; Maynard, Anthony, Marshall e Masiri, 2008; Penin, Vidal-Dupiol, & Adjeroud, 2013). Tuttavia, l’enorme mortalità dei coralli correlata allo sbiancamento negli ultimi anni suggerisce che il tasso di adattamento e/o acclimatazione è probabilmente insufficiente per tenere il passo con il ritmo del cambiamento climatico (van Oppen et al., 2017).
Inoltre, i modelli climatici prevedono che la maggior parte delle barriere coralline del mondo vivrà annualmente temperature estreme prima della fine del secolo (van Hoodink et al., 2016).
Un adattamento tempestivo per evitare l’estinzione può richiedere una nuova variazione genetica tramite interventi assistiti dall’uomo (Hamilton & Miller 2016; Hoffmann &Sgrò 2011; Kremer et al., 2012; Van Oppen,Oliver, Putnam e Gates, 2015; van Oppen et al.,2017).
Le opzioni di gestione mirate a migliorare la variazione genetica e il potenziale di adattamento di una specie o di una popolazione sono sempre più discusse sia nel contesto della rivegetazione che del ripristino della barriera corallina (Breed, Stead, Ottewell, Gardner e Lowe, 2013; Chan, Peplow, Menéndez, Hoffmann e Van Oppen, 2018; Hamilton & Miller 2016; Hoffman et al., 2015; Hoffmann & Sgrò 2011; Jones & Monaco 2009; van Oppen et al., 2017; Vitt, Havens, Kramer, Sollenberger, & Yates, 2010). Ciò rappresenta uno spostamento da un focus tradizionale sul ripristino di materiali genetici locali alla considerazione dell’utilizzo di variazioni genetiche non locali (Jones e Monaco 2009). Molti ecosistemi sono già stati drasticamente alterati dai cambiamenti climatici e da altri disturbi antropogenici, con il risultato non solo di una mancata corrispondenza tra tratti adattati localmente e condizioni ambientali alterate (Hamilton & Miller 2016; Jones & Monaco 2009), ma anche di un aumento della frammentazione della popolazione che riduce la diversità genetica e il potenziale di adattamento (Edmands, 2007; Hoffmann et al.,2015). Senza il flusso genico proveniente da altre popolazioni per migliorare la variazione genetica e il potenziale di adattamento, è improbabile che alcune popolazioni si adattino in tempo per persistere.
Inoltre, il ripristino del corredo genetico della popolazione originaria potrebbe non raggiungere obiettivi di conservazione a lungo termine se le popolazioni mancano delle varianti genetiche o dei geni necessari per sopravvivere a condizioni alterate ora o in futuro. Ad esempio, il castagno americano (Castanea dentata) è stato decimato dalla peronospora (una malattia fungina introdotta) perché privo dei geni per la resistenza alla peronospora (Clark, Schlarbaum, Saxton e Hebard, 2016; Newhouseet al., 2014). Pertanto, il ripristino della popolazione originaria di castagneti americani non si tradurrà probabilmente in boschi di castagni che persistano a lungo termine. Il forte calo delle dimensioni della popolazione del castagno americano ha causato cambiamenti nella composizione della comunità, nelle dinamiche degli insetti e della fauna selvatica, nonché nei processi chimici del suolo nelle foreste locali (Clark et al., 2016). Il ripristino riuscito delle specie che formano l’habitat come le canopie e i coralli è fondamentale, in particolare perché vi è un’alta probabilità che si verifichino effetti di flusso su altri componenti della biodiversità.
2.Migliorare la conservazione ed il successo del ripristino attraverso l'ibridazione
L’ibridazione può migliorare il potenziale di adattamento di una popolazione (Carlson, Cunningham e Westley, 2014; Chan et al.,2018; Hamilton & Miller 2016; Hoffmann & Sgrò 2011; Jones e Monaco 2009; Meier et al., 2017; van Oppen et al., 2015, 2017; Whiteley, Fitzpatrick, Funk e Tallmon, 2015; vedere la Tabella 1 per le definizioni delle terminologie relative a ibridazione). Aumenta l’eterozigosi e crea nuove combinazioni genetiche, riducendo potenzialmente il rischio di estinzione aumentando il potenziale di adattamento e mascherando gli alleli deleteri. L’ibridazione può portare a nuovi tratti adattativi, consentendo alle specie di invadere nuove nicchie ed espandere i loro areali di distribuzione (Becker et al., 2013; Carlson et al., 2014; Hamilton & Miller 2016; Hamilton et al., 2017; Hoffmann & Sgrò 2011; Meier et al., 2017; van Oppen et al., 2015). Il salvataggio genetico o il salvataggio evolutivo possono essere raggiunti quando una popolazione viene ripristinata con successo tramite ibridazione (tabella 2).

Il salvataggio genetico è applicabile a popolazioni piccole e isolate che in genere hanno una bassa diversità genetica e spesso soffrono di depressione da consanguineità (Carlson et al., 2014; Whiteley et al., 2015). L’ibridazione può portare un salvataggio evolutivo quando si verifica uno spostamento verso il fenotipo ottimale attraverso la selezione sui genotipi ibridi di nuova generazione o ricombinanti di ultima generazione (Carlson et al., 2014; Whiteley et al., 2015). In alcuni studi, il termine salvataggio evolutivo si applica strettamente all’adattamento a un ambiente che cambia dalla variazione genetica permanente (Hamilton & Miller 2016; Hufbauer et al., 2015). Usiamo la definizione più ampia, in cui il salvataggio evolutivo può comportare variazioni genetiche già presenti all’interno di una popolazione, derivanti da mutazioni de novo o introdotte attraverso l’immigrazione e l’ibridazione (Carlson et al., 2014; Whiteley et al., 2015). Il valore dell’ibridazione nella conservazione e nel restauro è stato dimostrato in diversi casi (Tabella 2). Ad esempio, l’introduzione di alcuni maschi da una popolazione geneticamente divergente alla popolazione rimanente dell’opossum pigmeo del Monte Buller che successivamente si è accoppiato con le femmine native (cioè, ibridazione intraspecifica) ha aumentato la sua forma fisica e ha contribuito alla prevenzione dell’estinzione di questa popolazione (Settimane et al.,2015). Altri esempi di successo nei vertebrati includono l’ibridazione nel lupo dinaviano scandinavo, nel pettirosso dell’Isola del Sud, nel gufo boobook dell’isola di Norfolk, nella pantera della Florida e nel lupo messicano (Tabella 2). La persistenza e la funzione dell’ecosistema del castagno americano possono anche essere ripristinate con successo in seguito all’ibridazione con il castagno cinese che ospita una resistenza geneticamente codificata al patogeno fungino che causa la peronospora (Clark et al.,2016)
3. Rischi e rischi percepiti dell'ibridazione come strumento di conservazione delle biodiversità
Le percezioni sui rischi associati al salvataggio genetico ed evolutivo attraverso l’ibridazione ne hanno ostacolato l’applicazione. Queste preoccupazioni includono (a) la possibilità di una depressione da ibridazione e (b) la perdita di specie parentali attraverso la mescolanza genetica. La depressione da ibridazione è la riduzione della forma fisica della progenie ibrida incrociata da due popolazioni o specie geneticamente divergenti (Edmands, 1999). Ciò può verificarsi quando l’ibridazione rompe complessi genici co-adattati o riunisce combinazioni di alleli con effetti negativi per segregazione e ricombinazione (Edmands, 2007; Hamilton & Miller 2016; Orr, 1996; Turelli, Barton, & Coyne, 2001).
Ad esempio, l’ibridazione tra Calylophus serrulatus (una pianta perenne di breve durata) proveniente da due ambienti diversi ha comportato una riduzione delle dimensioni del corpo e della fecondità negli ibridi di prima generazione (F1) (Heiser & Shaw 2006). Allo stesso modo, sebbene l’ibridazione abbia portato a una maggiore fitness in alcuni tratti nella prima o nelle due generazioni di copepodi marini e Drosophila spp., gli ibridi di generazione successiva hanno mostrato una fitness relativamente inferiore o nessun beneficio in termini di fitness (Edmands, 1999; Parda, 2014).
Tuttavia, il rischio di depressione da consanguineità è stato probabilmente sopravvalutato (Frankham, 2015; Hoffmann et al., 2015) e l’evidenza empirica della depressione da consanguineità è di gran lunga maggiore di quella della depressione da esogamia (Edmands, 2007). Le simulazioni e gli esperimenti sul campo mostrano anche che la depressione da riproduzione è probabilmente temporanea e può essere superata dalla selezione naturale (Aitken & Whitlock 2013; Erickson & Fester 2006). Ad esempio, sebbene la rottura ibrida si sia verificata nella generazione F2 di incroci intraspecifici nel legume Chamaecrista fasciculata, c’è stato un forte recupero della forma fisica da parte dell’F6 quando le piante erano ugualmente in forma o più in forma di entrambi i genitori (Erickson & Fenster 2006). Gli effetti della depressione da ibridazione rispetto al vigore ibrido dipendono dall’ambiente (Edmands, 2007). Una metanalisi ha dimostrato che l’ibridazione di una popolazione consanguinea con un’altra popolazione ha aumentato la fitness composita (cioè fecondità e sopravvivenza) del 148% in ambienti stressanti (ambienti naturali più variabili) rispetto al 45% in ambienti benigni (in cattività, ambienti meno variabili) e i risultati sono stati simili tra invertebrati, vertebrati e piante (Frankham, 2015). Ciò può essere dovuto a una maggiore capacità tampone degli eterozigoti, o perché le condizioni di stress aggravano gli effetti deleteri della depressione da consanguineità (Edmands, 2007). Il vantaggio dell’ibridazione è quindi probabilmente più comune negli ambienti alterati o degradati, che stanno diventando sempre più importanti a causa dei cambiamenti climatici.
La perdita dell’identità delle specie parentali e dell’unicità genetica a causa della mescolanza genetica attraverso l’ibridazione è un’altra preoccupazione che è stata ripetutamente sollevata (Allendorf, Leary, Spruell e Wenburg, 2001; Muhlfeld et al., 2014; Roberts, Gray, West e Ayre, 2010). Ad esempio, un cambiamento negli areali di distribuzione delle specie ha portato all’ibridazione dell’abramide comune degli estuari (Acanthopagrus butcheri) con l’abramide marina migratrice (A. australis), e successivamente solo il 5% delle popolazioni è rimasto di razza pura A. australis (Roberts et al., 2010). Allo stesso modo, l’ibridazione tra api mellifere africane ed europee nel tentativo di migliorare la produzione di miele di quest’ultima sottospecie ha portato alla scomparsa delle caratteristiche europee nel tempo (Schneider, Leamy, Lewis, & DeGrandi-Hoffman,2003). Mentre il rischio di rimescolamento genetico può essere applicabile nel contesto della conservazione delle specie attualmente definite, questo rischio può essere percepito in modo molto diverso se si adotta una visione incentrata sui geni anziché sulle specie (Crispo, Moore, Lee Yaw, Gray, & Haller, 2011; Hamilton & Miller 2016; Petit, 2004). Una visione incentrata sui geni può anche rivelare opportunità di conservazione che altrimenti sarebbero passate inosservate in una visione incentrata sulle specie. Ad esempio, quando una popolazione o una specie è a rischio di estinzione, l’ibridazione può preservare parte del genoma dei genitori che altrimenti andrebbe perso a causa dell’estinzione della specie (ad esempio, opossum pigmeo di montagna, pantera della Florida). La conservazione dell’unicità genetica non dovrebbe avere la priorità a scapito della diversità genetica (adattativa) (Coleman, Weeks, & Hoffmann, 2013; Hoffmann et al., 2015). Ad esempio, gli sforzi di conservazione basati sulla protezione dell’unicità genetica hanno deliberatamente isolato le popolazioni di Galax iella pusilla (pesci d’acqua dolce) e ciò ha probabilmente portato a una diminuzione della loro diversità genetica e del loro potenziale di adattamento (Coleman et al., 2013).
4. Quadro giuridico che impedisce l'utilizzo dell'ibridazione nella conservazione
Oltre ai rischi biologici percepiti, anche l’incerto status giuridico degli ibridi ne ha impedito l’uso nella conservazione.
Una revisione di 81 politiche di conservazione in Canada e negli Stati Uniti ha mostrato che solo 13 politiche (16%) forniscono linee guida riguardanti la gestione ibrida (Jackiw, Mandil e Hager, 2015). Ad esempio, il termine “ibrido” non compare nello US Endan gered Species Act (ESA; Haig & Allendorf 2006) e non esistono politiche ufficiali per la conservazione degli ibridi (Wayne & Shaffer 2016). Delle 13 politiche, sei non consentono la conservazione degli ibridi e considerano gli ibridi una minaccia per la biodiversità o non adatti alla conservazione (Jackiw et al., 2015). Gli ibridi interspecifici non sono protetti dal SEC, ad eccezione di alcune specie di piante che derivano dall’ibridazione (vonHoldt, Brzeski, Wilcove e Rutledge, 2018) e gli ibridi di sottospecie della pantera della Florida (Erwin, 2017; Lind-Riehl, Mayer, Wellstead e Gailing, 2016). Ad esempio, mentre Panthera tigris (tigre) e Panthera pardus (leopardo) e tutte le loro sottospecie allevate in cattività negli Stati Uniti sono protette dall’ESA, gli ibridi interspecifici delle due non sono protetti e possono essere legalmente uccisi e scambiati. negli Stati Uniti (U.S. v. Kapp 2005). Nel 1996, è stata proposta all’ESA una politica di interincrocio, che delinea possibili criteri quando una popolazione o una specie ibrida dovrebbe ricevere uno status legale per la protezione (Allendorf et al., 2001; Wayne & Shaffer 2016). Oltre 20 anni dopo, tuttavia, la politica non è stata né accettata né respinta dal Fish and Wildlife Service statunitense e dal National Marine Fisheries Services, e lo status legale degli ibridi viene valutato caso per caso su richiesta (Wayne & Shaffer 2016).
Allo stesso modo, anche lo status legale degli ibridi interspecifici non è chiaro ai sensi dell’Atto per la protezione dell’ambiente e la conservazione della biodiversità in Australia. Ad esempio, nel 1986 la popolazione del gufo boobook dell’isola di Nor folk è stata ridotta a una sola femmina e per salvare la popolazione sono stati introdotti due maschi di gufo libro boo della Nuova Zelanda. Il successivo allevamento degli ibridi di seconda e terza generazione ha stabilito una popolazione di 45 individui (Director of National Parks 2010). Nel 2010, il piano di recupero delle specie minacciate della regione dell’isola di Norfolk ha dichiarato che, a causa della natura ibrida di questa popolazione, sono escluse da un piano di recupero ai sensi dell’Environment Protection and Biodi versity Conservation Act (Director of National Parks 2010), ma il legale lo stato di questa popolazione non è mai stato chiarito (Garnett, Olsen, Butchart, & Hoffmann, 2011). A livello internazionale, la Lista rossa delle specie minacciate dell’Unione internazionale per la conservazione della natura (IUCN) esclude anche la considerazione di ibridi interspecifici per l’elenco, ad eccezione delle piante apomittiche (ovvero piante ibride che si riproducono asessualmente (vonHoldt et al., 2018). Ignorare gli ibridi nella conservazione rappresenta una discrepanza tra la politica, la scienza e le esigenze di conservazione del mondo reale (Richards & Hobbs2015), e un’importante revisione della legislazione sulla conservazione è in ritardo. Una revisione della legislazione sulla conservazione dovrebbe includere diverse considerazioni. In primo luogo, l’approccio di conservazione incentrato sulla specie nella legislazione attuale (ad esempio, ESA) è difficile da applicare in quanto le specie non sono entità fisse e sono in continua evoluzione. Inoltre, i confini tra le specie spesso non sono netti e la nostra comprensione dell’estensione del flusso genico naturale tra le specie è ancora limitata (Supple & Shapiro 2018).
Con l’avvento delle tecnologie genomiche sono state trovate tracce di commistione genetica in molte popolazioni “di razza”, rendendo molte specie attualmente protette dall’ESA non più conformi alle sue rigide interpretazioni (Erwin,2017; Wayne & Shaffer 2016). Ad esempio, nuove prove suggeriscono che i lupi rossi (Canis rufus) attualmente protetti dall’ESA sono probabilmente ibridi di lupi grigi (C. lupus) e coyote (C. latrans) (Waples, Kays, Fredrickson, Pacifici e Mills, 2018; Wayne & Shaffer 2016). In secondo luogo, gli episodi di ibridazione sono aumentati e continueranno ad aumentare in natura poiché i cambiamenti climatici spostano la distribuzione delle specie e riuniscono specie e popolazioni precedentemente isolate (Crispo et al., 2011; Garroway et al., 2010; Hillebrand et al., 2018; Moritz & Agudo 2013; Pauls, Nowak, Balint e Pfenninger, 2013; Pecl et al., 2017). In terzo luogo, il mancato riconoscimento degli ibridi può essere un’opportunità persa per proteggere le entità che possono mantenere le funzioni vitali dell’ecosistema. Ad esempio, il corallo ibrido Acropora prolifera continua a fornire funzioni ecosistemiche alle barriere coralline caraibiche, mentre i suoi lignaggi parentali, A. palmata e A. cervicornis, subiscono un declino significativo (Riquadro 1). Dato il tasso di cambiamento climatico, degrado ambientale e perdita di specie, il rifiuto di specie e popolazioni ibride può quindi essere costoso per la società e gli ecosistemi in generale
Box 1: Caso di studio: politica legale e la proliferazione di Hybrid Coral Acropora
Circa l’80% dei coralli sulle barriere coralline caraibiche è andato perduto dalla fine degli anni ’70 (Gardner, Côté, Gill, Grant e Watkinson, 2003), rappresentando un significativo declino della funzione dell’ecosistema e del benessere umano. Nel 2004, il National Marine Fisheries Service negli Stati Uniti ha ricevuto una petizione dal Center of Biological Diversity per elencare gli unici tre coralli Acropora caraibici esistenti, A. palmata, A. cervicornis e A. prolifera (cioè un ibrido naturale di A. palmata e A. cervicornis) come minacciati o minacciati dall’ESA (Biological Review Team 2005). Il Biological Review Team è stato successivamente riunito per esaminare lo stato di questi coralli e fornire raccomandazioni. Mentre A. palmata e A. cervicornis sono stati elencati come minacciati, il team ha concluso che il corallo ibrido A. prolifera non poteva soddisfare i criteri di specie secondo le definizioni ESA e lo status legale non è stato successivamente concesso (Biological Review Team 2005; Servizio nazionale per la pesca marittima 2014). Secondo l’ESA, “il termine specie include qualsiasi sottospecie di pesci o fauna selvatica o piante e qualsiasi segmento di popolazione distinto di qualsiasi specie di pesce vertebrato o fauna selvatica che si incrocia quando è maturo” (Biological Review Team 2005). Sebbene i dati genetici indichino che A. prolifera può reincrociarsi con A. cervicornis (Vollmer & Palumbi, 2002, 2007), non c’erano prove che potesse produrre ibridi di seconda generazione al momento della valutazione della petizione. Solo di recente l’esistenza della seconda generazione sul campo è stata confermata da analisi genetiche (Fogarty, Hightshoe, Bock, Budd e Baums, 2016).
Un numero crescente di dati molecolari ha portato a una migliore risoluzione tassonomica e, di conseguenza, il National Marine Fisheries Service ha adottato un atteggiamento leggermente più flessibile nei confronti delle specie, come dimostrato nella sua risposta del 2014 a una petizione per elencare 83 coralli costruttori di barriere sotto l’ESA . In questo caso, il Biological Review Team ha distinto tra una “specie buona”, che è una specie che mostra segni di incroci e/o reincrocio nella sua storia evolutiva, e una “specie ibrida”, che è una specie composta interamente da individui ibridi (National Marine Servizio Pesca 2014). In base a questa nuova definizione, una “buona specie”, pur avendo una storia di ibridazione, soddisfa ancora la definizione di specie e può essere protetta ai sensi dell’ESA. Tuttavia, A. prolifera è stata classificata come una “specie ibrida” a cui non può essere concesso lo status di protezione legale. Ironia della sorte, il Biological Review Team ha anche commentato che A. palmata e A. cervicornis “mostrano morfologie ramificate che forniscono un habitat importante per altri organismi della barriera corallina; nessun’altra specie corallina caraibica che costruisce la barriera corallina è in grado di svolgere queste funzioni ecosistemiche” e il tasso di perdita di corallo suggerisce “è altamente probabile che queste funzioni ecosistemiche siano state fortemente compromesse” (Biological Review Team 2005). Contrariamente al declino di A. palmata e A. cervicornis, l’ibrido, A. prolifera, mostra un recente aumento dell’abbondanza in diverse località della barriera corallina caraibica (Aguilar-Perera & Hernández-Landa 2017; Fogarty, 2012; Japaud, Fauvelot, & Bouchon, 2014), e studi di laboratorio e sul campo dimostrano che A. prolifera è altrettanto in forma o più in forma delle sue specie parentali (Fogarty, 2012). A. prolifera continua a fornire habitat e funzioni ecosistemiche alle barriere coralline caraibiche e sostiene comunità di altri organismi della barriera corallina che altrimenti sarebbero andati perduti con la diminuzione delle sue specie parentali.
5. Andando oltre le strategie di conservazione e le politiche giuridiche
Migliorare il potenziale di adattamento di una popolazione attraverso l’ibridazione è attualmente una scelta gestionale sottoutilizzata a causa dei suoi rischi percepiti (Fitzpatrick et al., 2016; Frankham et al., 2011; Hufford & Mazer 2003) e le limitazioni nel suo quadro giuridico esistente (Wayne & Shaffer 2016). Come spiegato in precedenza, i rischi percepiti sono probabilmente sopravvalutati e le applicazioni dell’ibridazione nella conservazione hanno portato a diversi esiti positivi. Suggeriamo che le politiche di conservazione si allontanino dalla visione rigida delle specie e si concentrino invece sui processi evolutivi che sono importanti per il potenziale di adattamento e sulla conservazione della funzione dell’ecosistema. Incoraggiamo le agenzie statali e/o federali a prendere in considerazione una revisione della legislazione sulle specie in via di estinzione o sulla conservazione della biodiversità e proponiamo una serie di raccomandazioni che possono aiutare tale transizione:
- Adottare una visione dinamica delle “specie”, riconoscendo le “specie” come lignaggi in continua evoluzione e non come entità fisse.
- Adottare una visione incentrata sui geni anziché sulle specie nelle pratiche di gestione della conservazione e nelle politiche legali (Crispo et al., 2011; Hamilton & Miller 2016; Petit, 2004), ed includere la considerazione dei processi evolutivi che sono essenziali per massimizzare il potenziale di adattamento (Eiza guirre & Baltazar-Soares 2014; Hoffmann et al., 2015; Hoffmann & Sgrò 2011; Settimane et al., 2011). In questo contesto, le popolazioni ibride (ad esempio, il corallo A. prolifera) che sono serbatoi del materiale genetico dei loro genitori dovrebbero ricevere uno status di protezione legale.
- Prepararsi ad andare oltre la conservazione o il ripristino della diversità genetica locale quando la gestione tradizionale non è riuscita a mantenere la popolazione o le funzioni dell’ecosistema, o il fallimento è imminente. Ciò include (a) popolazioni che sono piccole, isolate e che soffrono di depressione da consanguineità, (b) popolazioni prive di varianti genetiche o geni vitali per la sopravvivenza e (c) popolazioni che difficilmente si adatteranno in tempo per tenere il passo con il cambiamento climatico (vedi albero decisionale).
- Valutare il rischio di opzioni di gestione alternative (ad esempio, ibridazione) contro il rischio di estinzione e la perdita di funzionalità del sistema ecosistemico se queste opzioni alternative non vengono prese in considerazione (Hoegh-Guldberg et al., 2008; McLachlan, Hellmann & Schwartz, 2007; Vitt et al., 2010). Considera qual è la probabile traiettoria della popolazione a rischio se continuano solo gli sforzi di conservazione tradizionali.
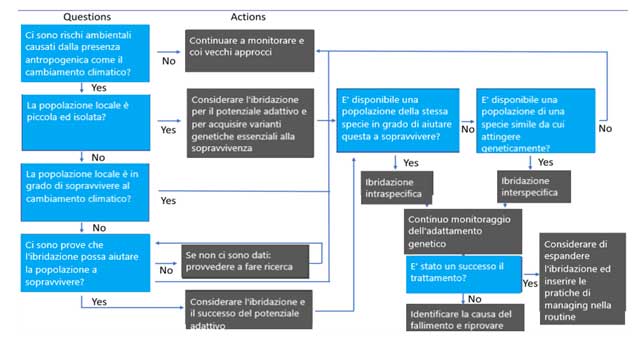
6. Valutare l'idoneità dell'ibridazione come strumento di conservazione: un albero decisionale
Per assistere la transizione da un approccio basato sulle specie e facilitare il processo decisionale per i gestori della conservazione in merito all’uso dell’ibridazione, viene qui presentato un albero decisionale come guida pratica. Se l’ibridazione è ritenuta opportuna, la fase successiva prevede la selezione di una o più popolazioni o specie idonee per l’ibridazione con la popolazione interessata.
L’ibridazione intraspecifica è la prima opzione preferita se è fattibile e vantaggiosa. Poiché ci si aspetta che le popolazioni della stessa specie abbiano una maggiore parentela rispetto alle popolazioni di specie diverse, si prevede che la probabilità di ibridazione riuscita sia maggiore e che si verifichi una depressione da ibridazione minore.
L’ibridazione intraspecifica può essere applicata se è disponibile una popolazione della stessa specie e presenta caratteristiche che soddisfano l’obiettivo di conservazione (ad esempio, presenta un’elevata diversità genetica o può fornire specifici tratti desiderati). Esempi di ciò includono l’introduzione di maschi conspecifici provenienti da popolazioni sane e geneticamente diverse nella popolazione di opossum pigmeo di Mount Buller geneticamente impoverita (Weeks et al., 2017); e incrocio intraspecifico di coralli da una latitudine più alta e più bassa per migliorare la tolleranza termica delle popolazioni di corallo alla latitudine più alta (Dixon et al., 2015; van Oppen, Puill-Stephan, Lundgren, De’ath, & Baia, 2014). Se l’ibridazione intraspecifica non è fattibile o non è in grado di raggiungere l’obiettivo di conservazione, si può prendere in considerazione l’ibridazione interspecifica. Specie idonee strettamente imparentate possono portare a un aumento maggiore della diversità genetica e del potenziale di adattamento, o fornire adattamenti specifici che mancano alla specie di interesse (ad esempio, resistenza alla peronospora del castagno americano). Tuttavia, una maggiore distanza genetica tra le specie può aumentare la probabilità di incompatibilità genetica e il rischio di depressione da ibridazione, pertanto l’ibridazione intraspecifica viene considerata per prima. Dopo che è stata selezionata una popolazione/specie idonea ed è stata effettuata l’ibridazione attuato, è necessario un monitoraggio continuo per monitorare il successo del programma e monitorarne attentamente le conseguenze. Ciò può includere misurazioni della dimensione della popolazione, della composizione della popolazione (ad esempio, frequenza di genotipi ibridi rispetto a quelli di razza pura in diverse generazioni), diversità genetica (ad esempio, livello di ricchezza allelica, eterozigosi), fitness, longevità e funzioni ecologiche (es., diversità della fauna associata, produzione primaria). È anche importante tenere traccia di quali specie/popolazioni o individui hanno agito come genitori materni e paterni di ibridi di generazioni successive e prole incrociata per aiutare a comprendere i fattori genetici che hanno contribuito ai risultati osservati di mutamento.
7. Direzioni per futuri sforzi di ricerca ed osservazioni conclusive
Quando è improbabile che una popolazione si adatti in tempo per sopravvivere ai cambiamenti climatici, i risultati degli studi di laboratorio e sul campo sull’idoneità ibrida diventano un’informazione importante in termini di decisione se implementare o meno l’ibridazione (vedi albero delle decisioni). Poiché non è possibile fornire dati sperimentali per ogni specie, i risultati di un sottoinsieme di specie o popolazioni possono fornire prove di concetto per gruppi che condividono caratteristiche biologiche ed ecologiche simili. La ricerca per informare il processo decisionale dovrebbe comportare test multigenerazionali di ibridi in laboratorio e in natura (Hamilton e altri, 2017). La nostra revisione mostra che gli studi a lungo termine sono rari per la ricerca sull’ibridazione correlata alla conservazione e la maggior parte dei dati è stata ottenuta per le generazioni F1 e F2 (Tabella 2). Per decidere se l’ibridazione probabilmente migliorerà il successo della conservazione, idealmente dovrebbero essere testate almeno due generazioni in modo che il potenziale riproduttivo degli ibridi, così come il potenziale effetto della segregazione e della ricombinazione (ad esempio, la possibilità di depressione da riproduzione) possa essere valutato (Edmands, 2007; Hamilton et al., 2017). Inoltre, ripristino riuscito di una popolazione a rischio non è misurato solo da un miglioramento dei tratti individuali, ma anche da un significativo rimbalzo delle dimensioni della popolazione (Carlson et al., 2014; Whiteley et al., 2015). Un aumento della idoneità ibrida in uno o più tratti in laboratorio potrebbe non riflettere i risultati in natura; pertanto, gli studi sul campo sono essenziali (Fitzpatrick et al., 2016). Quando vengono prese le decisioni e viene implementata l’ibridazione, dovrebbe essere in atto un monitoraggio continuo per quantificare i vantaggi di fitness associati all’ibridazione e al cambiamento genetico (vedi albero delle decisioni, Figura 2; Weeks et al., 2017). Nel caso in cui le popolazioni siano piccole e isolate, la deriva genetica e la consanguineità possono nuovamente ridurre la diversità genetica nel tempo e potrebbe essere necessaria un’ibridazione multipla o periodica (Heber et al., 2013) I progressi nelle tecnologie genomiche e nella scienza del clima richiedono una revisione del nostro attuale atteggiamento, approccio e politiche legali per la conservazione. Ora siamo in grado di prendere decisioni più informate sulla base di una migliore comprensione delle delineazioni delle specie e delle previsioni del futuro cambiamento climatico. L’adozione di una visione incentrata sui geni e una posizione meno rigida sulle “specie”, oltre a riconoscere l’importanza dei processi evolutivi e del potenziale di adattamento sulla sopravvivenza della popolazione, faciliterà misure tempestive e pratiche per affrontare le esigenze di conservazione in un mondo che cambia.

